- Вопросы пациентов
- 1. Если назначена после операции лучевая терапия, то каких осложнений от нее можно ожидать?
- 2. Можно ли во время операции не удалять яичники?
- 3. Можно ли жить половой жизнью при таком диагнозе?
- Борьба с психологическим дискомфортом при метастазах в подвздошной кости
- Измените свое мышление
- Найдите способы расслабления
- Общайтесь с людьми
- Будьте в движении
- Психологическая помощь при лечении рака матки
- Вопрос-ответ:
- Какие симптомы свидетельствуют о раке матки?
- Какими методами диагностируют рак матки?
- Какие пути метастазирования при раке матки?
- Какие методы лечения рака матки?
- Каковы прогнозы при раке матки на разных стадиях заболевания?
- Можно ли предотвратить развитие рака матки?
- Зачем нужно посещать онкогинеколога регулярно
- Метастаз в подвздошной кости: симптомы и лечение
- Рак костей таза
- Понятие о раке, статистика
- Реабилитация после лечения рака матки
- Физическая реабилитация
- Психологическая поддержка
- Контрольный осмотр
- Жидкость малого таза после удаления матки и яичников
- Факторы, способствующие метастазам в подвздошной кости
- Канцероматоз малого таза: причины возникновения и распространения
- Симптомы наличия опухоли
- Симптомы патологии
- Профилактика асцита при онкологии
- Методы диагностики и оценки распространённости рака предстательной железы
Вопросы пациентов
1. Если назначена после операции лучевая терапия, то каких осложнений от нее можно ожидать?
В настоящее время для проведения лучевой терапии в Центре используется новейшее оборудование, которое позволяет минимизировать лучевые реакции и осложнения.
Как правило, назначается дистанционная лучевая терапия на малый таз. Следовательно, возможны лучевые реакции и осложнения со стороны тех органов, которые попадают в зону облучения:
- мочевой пузырь;
- влагалище;
- прямая кишка.
При появлении неприятных ощущений, нарушении функций указанных органов необходимо обратиться к специалисту нашего отделения.
2. Можно ли во время операции не удалять яичники?
Нельзя. Яичники в обязательном порядке удаляют вместе с маткой. Это гормональный орган, который участвует в патологическом обмене веществ, приводящем к раку эндометрия. Помимо этого, яичники являются одним из основных органов-мишеней, в которые метастазирует рак эндометрия в первую очередь.
Иногда пациентки переживают из-за того, что они после удаления яичников “перестанут быть женщинами”. Это не так. Вторичные половые признаки после удаления яичников не исчезнут. Женские половые гормоны все равно будут синтезироваться в организме, но не в таких количествах. Эту функцию на себя берут другие органы внутренней секреции, например, надпочечники.
После удаления яичников у женщин до наступления менопаузы развивается в той или иной степени климактерический (кастрационный) синдром. Как показывает практика, в большинстве случаев он переносится достаточно легко и через определенное время (1-2 месяца) проходит.
Проявляется он в виде вегетативных реакций:
- увеличение частоты сердечных сокращений;
- потливости;
- появления чувства жара или озноба, иногда страха;
- повышения артериального давления.
Эти реакции не несут никакой серьезной угрозы организму, но если они “не дают покоя”, приводят к различным невротическим состояниям и снижению трудоспособности, то возможно назначение негормональных препаратов, какие обычно применяются при наступлении физиологического климакса. В таких случаях нужно посоветоваться и получить рекомендации онкогинеколога.
3. Можно ли жить половой жизнью при таком диагнозе?
Можно. В большинстве случаев такой вопрос волнует женщину после операции. Если в послеоперационном периоде не назначается лучевая терапия, то половой жизнью можно жить не ранее, чем через 1,5-2 месяца после операции. Перед этим желательно проконсультироваться у гинеколога.
Если в послеоперационном периоде назначена лучевая терапия, то половую жизнь следует начинать не ранее, чем утихнут лучевые реакции. Точных сроков назвать невозможно из-за того, что у организма каждой женщины свой порог переносимости лучевой терапии.
Перед началом половой жизни также необходимо проконсультироваться у гинеколога.
Борьба с психологическим дискомфортом при метастазах в подвздошной кости
Измените свое мышление
Когда человек получает диагноз рака или метастазов, его ум перегружается негативными мыслями и страхом. Это влияет на эмоциональное состояние и ухудшает качество жизни
Поэтому важно подумать о позитивном восприятии ситуации. Больше фокусируйтесь на хорошем, поддерживайте оптимистическое мышление и концентрируйтесь на силе воли
Найдите способы расслабления
Стресс и тревожность могут усугубить психологическое состояние людей с диагнозом метастазов в подвздошной кости
Поэтому важно находить способы расслабления, такие как медитация, йога, тай-чи или глубокое дыхание. Вам необязательно идти в специальные клубы и группы, вы можете просто потратить время в тишине, занимаясь другими видами хобби — рисованием, чтением или слушанием музыки
Общайтесь с людьми
Полагаться на других людей может помочь вам облегчить психологический дискомфорт. Имейте людей, которые могут поддержать вас во время трудных моментов. Не стесняйтесь делиться своими чувствами с друзьями и близкими. Расскажите им о своих переживаниях, что вас беспокоит и какие моменты пробуждают у вас страх. Не бойтесь спрашивать об опыте других, которые уже прошли через подобную ситуацию, и обратитесь к профессиональной помощи.
Будьте в движении
Физическая активность помогает не только поддерживать форму, но также предотвращает стресс и тревогу. Найдите вид спорта или еще один физический вид деятельности, который вы можете приятно проводить. Хороший выбор может быть плавание, ходьба на свежем воздухе, занятие в спортивном зале или катание на велосипеде. Это также отличный способ социализации и общения с людьми.
Психологическая помощь при лечении рака матки
Рак матки – это сложное заболевание, требующее комплексного лечения и поддержки пациента на разных уровнях. Одним из важных аспектов лечения онкологического заболевания является психологическая помощь.
Психологическая поддержка помогает пациентам справиться с эмоциональным стрессом, связанным с диагнозом онкологического заболевания и его лечением. Психолог помогает пациентам осознать свои чувства и эмоции и научиться эффективно справляться с ними.
Важно отметить, что поддержка психолога необходима не только пациентам, но и их близким. Заболевание одного члена семьи влияет на всю семью, и поддержка психолога может помочь справиться со стрессом и адаптироваться к новой ситуации
Рак матки – это не приговор. Сегодня существует множество методов лечения и поддержки пациентов. Поддержка психолога – это один из важных компонентов комплексной терапии, который помогает пациентам пройти через все этапы болезни и вернуться к полноценной жизни.
Вопрос-ответ:
Какие симптомы свидетельствуют о раке матки?
Среди симптомов рака матки могут быть: обильные месячные кровотечения, кровотечения после полового акта, боли внизу живота, выделения с неприятным запахом и т.д. Однако, часто рак матки на ранней стадии может проходить без симптомов.
Какими методами диагностируют рак матки?
Для диагностики рака матки используют эхографию матки, гистерографию, магнитно-резонансную томографию, биопсию матки и т.д.
Какие пути метастазирования при раке матки?
Метастазирование при раке матки может происходить лимфогенным, гематогенным путем или через имплантацию в окружающие органы.
Какие методы лечения рака матки?
Методы лечения рака матки зависят от стадии заболевания и включают в себя: хирургическое удаление опухоли, радиационную терапию, химиотерапию и комплексную терапию.
Каковы прогнозы при раке матки на разных стадиях заболевания?
На ранних стадиях рака матки прогнозы лечения обычно благоприятные. Однако, при распространении метастазов прогнозы значительно ухудшаются. На поздних стадиях заболевания выживаемость пациентов снижается до 15-20%.
Можно ли предотвратить развитие рака матки?
Проведение профилактических осмотров, своевременное лечение воспалительных заболеваний малого таза, отказ от курения и алкоголя, рациональное питание и умеренные физические нагрузки помогают снизить риск развития рака матки.
Зачем нужно посещать онкогинеколога регулярно
Рак матки — это один из наиболее распространенных видов онкологии среди женщин. К сожалению, многие не обращают внимания на первые признаки болезни и затягивают визит к врачу. Но чем раньше диагностируется рак матки, тем больше шансов на его успешное лечение.
Регулярные визиты к онкогинекологу могут выявить заболевание еще на ранней стадии, что позволит начать лечение на ранней стадии и предотвратить развитие опасных осложнений.
Кроме того, визит к онкогинекологу необходим даже в отсутствие симптомов заболевания. Регулярные осмотры помогут выявить отклонения на ранних стадиях и предотвратить развитие раковых опухолей, которые могут оставаться незамеченными в течение многих лет.
Не забывайте о необходимости заботиться о своем здоровье и регулярно проверяться у онкогинеколога. Это поможет сохранить здоровье и предотвратить развитие онкологии матки.
Метастаз в подвздошной кости: симптомы и лечение
Метастаз в подвздошной кости – это опасное заболевание, которое сопровождается нарушениями в работе опорно-двигательной системы. Поражение подвздошной кости метастазами – прямое следствие онкологического процесса в других органах и тканях человека. Как правило, метастазы в подвздошной кости возникают на фоне рака молочной железы, половых органов, легких, желудочно-кишечного тракта, а также рака почек.
Основными симптомами метастаза в подвздошной кости являются: болезненность в области таза, снижение подвижности конечностей, появление искривления хребта, нарушение функций мочевого пузыря и прямой кишки, повышенный уровень кальция в крови, что приводит к общей слабости и потере аппетита.
Для лечения метастаза в подвздошной кости используются различные методы: операционное вмешательство, химиотерапия, лучевая терапия. Какой метод лечения выбрать в каждом конкретном случае, зависит от стадии онкологического процесса, общего состояния пациента и других факторов. Обычно выбор метода лечения определяет врач-онколог.
- Операция. В случае метастаза в подвздошной кости операция заключается в удалении пораженной ткани. В ряде случаев операция может оптимизировать лечение и снизить риск повторного развития метастаза.
- Химиотерапия. Химиотерапия направлена на уничтожение раковых клеток с помощью специальных препаратов. Химиотерапия может быть использована в качестве самостоятельной терапии или в сочетании с операцией.
- Лучевая терапия. Лучевая терапия – это метод лечения, основанный на использовании ионизирующего излучения. Лучевая терапия может быть использована в сочетании с другими методами лечения, а также как самостоятельная методика.
В любом случае, лечение метастаза в подвздошной кости требует индивидуального подхода. При наблюдении симптомов, характерных для данного заболевания необходимо обращаться к врачу и проводить регулярные обследования для своевременного выявления и лечения онкологических заболеваний.
Рак костей таза
Саркома костей таза достаточно редкостное заболевание и в основном представлена остеосаркомой Юинга. В связи с тем, что полное окостенение костной структуры малого таза происходит после рождения, в данной области в одинаковой мере встречаются остеосаркомы (злокачественная опухоль, характеризуемая агрессивным ростом раковых клеток, происходящих из костных тканей) и хондросаркомы (агрессивные злокачественные опухоли, образующиеся из хрящевых клеток).
Остеосаркома:
Рак костей таза преимущество поражает детей и подростков и характеризуется особенно злокачественным ростом с ранним образованием метастазов.
Заболевание в начальном периоде протекает бессимптомно. В некоторых пациентов может наблюдаться кратковременное поднятие температуры тела. В процессе развития злокачественного новообразования больных начинают беспокоить приступы боли, интенсивность которой увеличивается во время физической нагрузки на тазобедренный сустав. Опухоль, постепенно увеличиваясь в размерах, может проявляться при визуальном осмотре в виде истончения кожных слоев и выпячивания в данной области. Увеличение размеров остеосаркомы сопровождается нарастанием болевого синдрома из-за повреждения сосудов, нервных волокон и давления на внутренние органы.
Лечение данного вида рака костей таза включает применение химиотерапии и последующее оперативное удаление патологических тканей. После хирургического вмешательства пациентам требуется проведение эндопротезирования для восстановления функции тазобедренного сустава.
Хондросаркома:
Это раковые заболевания хрящевой части тазовых костей. Врачи-онкологи отмечают наибольшее число таких поражений у мужчин 20-60 лет.
Ключевые симптомы проявления рака включают интенсивный болевой синдром, для которого типичным является иррадиация боли (распространение неприятных ощущений по ходу нервных окончаний). Дополнительными признаками хондросаркомы выступают: отек мягких тканей бедренного участка, нарушения функции ходьбы из-за приступов резкой боли и выпячивание хрящевых тканей в зоне поражения.
Лечение рака костей таза данного вида аналогично остеоидному лечению и заключается в приеме курса цитостатических средств и хирургической операции по иссечению злокачественного новообразования.
Понятие о раке, статистика

По статистике в России ежегодно о раке матки узнает более 16 тысяч женщин, и с каждым годом эта цифра только увеличивается. Чаще всего болезнь поражает представительниц прекрасного пола после 60 лет, но 40% женщин заболевает еще до наступления климакса. В последние десяток лет увеличился процент девушек моложе 30, которые столкнулись с подобной онкологией.
Из женских онкологических заболеваний данный вид рака стоит на втором месте после рака груди, но так как для него характерно стремительное развитие симптоматики, которая заставляет женщину обращаться к врачу, то в 90% случае опухоль диагностируют еще на ранней стадии.
Реабилитация после лечения рака матки
Физическая реабилитация
После окончания курса лечения рака матки начинается физическая реабилитация. Врач назначает комплекс упражнений, облегчающих восстановление организма. Рекомендуется заниматься физическими упражнениями, которые не вызывают чрезмерной нагрузки на тело.
Также важно следить за режимом питания и употреблять продукты, богатые витаминами и минералами. Кроме того, необходимо отказаться от вредных привычек и укрепить свой иммунитет
Психологическая поддержка
После лечения рака матки пациентки испытывают психологические трудности. Они могут чувствовать страх, тревогу, депрессию
Поэтому так же важно обратиться к психологу, который поможет снять психологическое напряжение
Позитивное мышление и поддержка родных и близких тоже являются важными составляющими восстановления психологического равновесия.
Контрольный осмотр
После прохождения курса лечения и реабилитации необходимо проходить регулярные осмотры у врача-онколога. Они помогут выявить рецидив заболевания и начать лечение в самом раннем стадии.
Также врач-онколог контролирует работу всех органов и систем организма, особенно тех, которые были наиболее пострадали во время лечения.
Жидкость малого таза после удаления матки и яичников
У пациенток после экстирпации матки изменяются анатомические взаимоотношения органов малого таза, что может затруднять проведение адекватной оценки при мануальном гинекологическом исследовании. Для диагностики опухолей, локализующихся в этой области, в таких случаях требуется дополнительное клинико-лабораторное обследование и применение различных методов визуализации. Удаление матки усложняет проведение ТВЭ, поскольку изменяется анатомическое положение яичникков.
Увеличенная в объеме остаточная ткань яичника часто бывает фиксирована спайками к боковой стенке таза, что может приводить к частичной обструкции мочеточника вследствие его компрессии. У женщин после экстирпации матки картину опухолей малого таза могут создавать послеоперационные гематомы и нерасширенные петли кишечника. Эхографические характеристики гематом значительно варьируют от анэхогенных до гипоэхогенных в зависимости от степени их организации. В постменопаузе яичники должны иметь маленькие размеры и с трудом выявляться.
В некоторых случаях участок большого сальника может образовывать складку и определяться как солидное образование. Он может быть подпаян к куполу влагалища или брюшине позадиматочного пространства, имитируя ткань яичника. Эти две ткани зачастую бывает трудно дифференцировать с помощью эхографии после операции. При наличии послеоперационного спаечного процесса между спайками может накапливаться жидкость, что приведет к формированию серозоцеле.
У пациенток после экстирпации матки трансвагинальное ультразвуковое исследование оказывает пользу при диагностике образований, прилежащих к куполу влагалища или придаткам. Вследствие близости трансвагинального датчика к яичникам они сами и образования, исходящие из них, дифференцируются более точно. Возможности метода могут быть ограничены, если у пациенток после экстирпации матки имеется короткая культя влагалища или его атрофия.
Проводимая у пациенток со злокачественными образованиями лучевая терапия может приводить к местному фиброзированию тканей, еще более усложняя обследование таза. На фоне такой терапии влагалище становится укороченным, узким и ригидным, в связи с чем при мануальном гинекологическом исследовании возникают трудности при оценке зоны проекции придатков и надлобковой области. Поэтому эхография и КТ являются важными дополнительными диагностическими средствами при определении тактики ведения таких пациенток. При этом наиболее оптимально, если получаемые в будущем данные сравниваются с результатами первоначального обследования.
Иногда встречаются пациентки после надвлагалищной ампутации матки. Эта операция заключается в удалении тела матки с сохранением шейки, что делает возможным клинически ошибочное определение шейки матки как образование таза и сохраняет вероятность развития карциномы шейки матки. В настоящее время в Европе эта методика удаления матки широко не применяется. После экстирпации матки вследствие отека культи влагалища, который продолжается около 6 нед, плановое контрольное ультразвуковое исследование рекомендуется выполнять через 2-3 мес после операции.
Размеры влагалища и его купола будут отличаться у разных пациенток, поскольку они зависят от возраста, степени атрофических изменений, типа операции и дозы облучения, если оно проводилось. В целом чем старше женщина, чем более обширное вмешательство было выполнено и выше полученная доза облучения, тем меньшие размеры оставшегося влагалища можно ожидать у пациентки. Размер купола также зависит от особенностей хирургического вмешательства. Он будет определяться объемом тканей, вовлеченных в швы, и типа шва, наложенного для закрытия просвета влагалища. Обычно при эхографии купол влагалища представляет собой структуру размером 1-1,5 см в области своего верхнего полюса.
После определения при первом плановом послеоперационном осмотре размеров и конфигурации купола в дальнейшем следует следить, чтобы его размеры у конкретной пациентки не изменялись в сторону увеличения, а с возрастом женщины постепенно уменьшались. Если во время наблюдения регистрируется увеличение размеров, необходимо рассмотреть вероятность рецидива опухоли. Подпаянная к верхней части влагалища петля кишки или яичник могут ложно расцениваться как рецидив опухоли в культе влагалища. Во всех случаях выявления подозрительных данных показано использование водной клизмы во время ультразвукового исследования для более тщательной оценки состояния стенок влагалища и дифференцирования образований, имеющих отношение к тонкому и толстому кишечнику. После операций могут формироваться серозоцеле (инклюзионные кисты).
Факторы, способствующие метастазам в подвздошной кости
Метастазы в подвздошной кости являются частым осложнением онкологических заболеваний различной локализации. Существует ряд факторов, которые могут способствовать возникновению и прогрессированию метастазов в данной области:
- Удаленные метастазы. Раковые клетки могут распространяться через кровь и лимфу от первичного очага, например, от рака молочной железы или легкого, и затем колонизировать подвздошную кость.
- Нарушение целостности кости. Причиной метастазов может стать повреждение кости: переломы, травмы, операции. В месте повреждения образуется очаг изменений, который может стать местом колонизации раковых клеток.
- Прием гормональных препаратов. Некоторые гормональные препараты, используемые при лечении онкологических заболеваний, такие как аналоги гонадолиберина, могут увеличивать вероятность метастазов в подвздошной кости.
- Возраст. С возрастом увеличивается вероятность развития онкологических заболеваний в целом, и, соответственно, их метастазов в кости.
Важно отметить, что наличие этих факторов еще не означает появление метастазов в подвздошной кости. Каждый случай индивидуален, и необходимо учитывать все факторы риска при диагностике, лечении и профилактике метастазов
Канцероматоз малого таза: причины возникновения и распространения
Канцероматоз малого таза, также известный как метастатический рак малого таза, — это состояние, при котором раковые клетки распространяются из первичного очага в другие органы и ткани малого таза. Процесс распространения раковых клеток называется метастазами. Канцероматоз малого таза является запущенной формой рака и часто характеризуется плохим прогнозом выживаемости.
Причины возникновения канцероматоза малого таза:
- Распространение раковых клеток от первичного очага. Канцероматоз малого таза обычно является последствием распространения раковых клеток из гинекологических или желудочно-кишечных опухолей. Раковые клетки могут распространяться через лимфатическую систему или кровь.
- Неправильное лечение или отсутствие лечения рака. Если первичный рак не был полностью удален или лечение не назначено или отсрочено, это может способствовать распространению раковых клеток в малый таз.
- Рецидив рака. После успешной терапии рак может вернуться в виде рецидива, а распространение раковых клеток в малый таз может быть одним из проявлений рецидива.
Распространение канцероматоза малого таза:
Раковые клетки могут распространяться из первичного очага в следующие органы и ткани малого таза:
- Лимфатические узлы малого таза — это первые органы, в которые раковые клетки могут попасть из первичного очага. Возможное распространение раковых клеток включает лимфатические узлы таза, паховые лимфатические узлы и другие лимфатические узлы поблизости.
- Плевра — это мембрана, покрывающая легкие и образующая полость между легкими и грудной клеткой. Раковые клетки могут распространиться на плевру в результате метастазирования в малый таз.
- Мочевой пузырь и прямая кишка — раковые клетки могут распространиться на соседние органы малого таза, такие как мочевой пузырь и прямая кишка.
- Кишечник — раковые клетки могут распространиться на сам кишечник или на его стенки.
- Мочеточники и почки — в некоторых случаях раковые клетки могут распространиться на мочеточники и затем на почки.
Распространение канцероматоза малого таза является серьезным осложнением рака. Лечение данного состояния зависит от многих факторов, включая тип и стадию рака, а также общее состояние пациента. Обычные методы лечения включают хирургическое вмешательство, химиотерапию, лучевую терапию и иммунотерапию.
Симптомы наличия опухоли
В малом тазу находятся следующие органы:
- кишечный тракт;
- мочевой пузырь;
- репродуктивная система;
- родовые пути;
- яичники;
- простата.
Все злокачественные новообразования в малом тазу могут относиться к следующим заболеваниям:
- заболевание мочевого пузыря. Онкологическое злокачественное поражение слизистых оболочек. Частота заключается в пределах 5% от всех случаев раковых болезней. У представителей сильного пола онкология мочевого пузыря развивается в 4 раза больше, нежели у женщин;
- колоректальное образование. Поражение раковыми клетками прямой кишки;
- онкологическое заболевание предстательной железы. Встречается часто у мужчин;
- маточная онкология. Самое встречающееся заболевание у женщин, идет поражение репродуктивных органов;
- онкология шейки матки. Заболевание развивается на базе процессов в придатках, которые длительный период не поддаются излечению. Эта болезнь встречается очень редко;
- онкология яичников у представительниц слабого пола. Встречается довольно часто у женщин в больших городах.
Несмотря на существование большого количества опухолей, образующихся вне органов малого таза, признаки, соответствующие образованиям в малом тазу во многом похожи. Эта разновидность онкологических заболеваний отличается отсутствием симптоматики на начальных стадиях развития. Увеличиваясь в объемах вне органов, опухоли могут в течение некоторого времени достичь очень больших размеров и при этом они могут не давать о себе знать.
Симптомы новообразований малого таза могут быть незначимыми и проявляться:
- в форме затрудненного мочеиспускания;
- в виде непроходимости кишечника;
- может проявляться поясничная боль;
- могут появиться тяжесть в ногах, боль в брюшной полости.
Общее здоровье и состояние пациента может длительное время оставаться обычными, в том числе и в случае если у него развилась уже достаточно большая опухоль. Больной при этом может претерпевать следующие неприятности со здоровьем:
- регулярная слабость тела;
- быстрая утомляемость;
- понижение веса;
- нестабильная температура тела;
- интоксикация.
Болевые ощущения в области живота относятся к первичным признакам опухоли злокачественного происхождения. Боль бывает замечено при новообразованиях небольшого размера. Происходит сдавливание нервных окончаний, соединенных с поясничным отделом или с крестцом.
Опухоль обнаруживается в ходе ощупывания живота. Этого может быть вполне достаточно для определения наличия заболевания. Опухоли, которые образовались в брюшной области справа, выдают ранние симптомы и проявляются венозным застоем.
Вообще в брюшной полости различные новообразования способны длительный период не давать знать о себе. Что очень затрудняет постановку своевременного диагноза.
Симптомы, сообщающие о наличии онкологии малого таза, поражающей кишечный тракт, могут быть многообразны. Они могут различаться в зависимости от размера и расположения новообразования. Могут появиться болезненные ощущения в области живота, в кале может присутствовать слизь и кровь, общее расстройство кишечного тракта. Основным считается присутствие болей в придатках.
Признаками онкологии мочевого пузыря считается следующее: присутствие кровяных сгустков в моче, неправильные позывы к мочеиспусканию, несоблюдение опорожнения пузыря, болевые чувства в паху и болезненность половых органов.
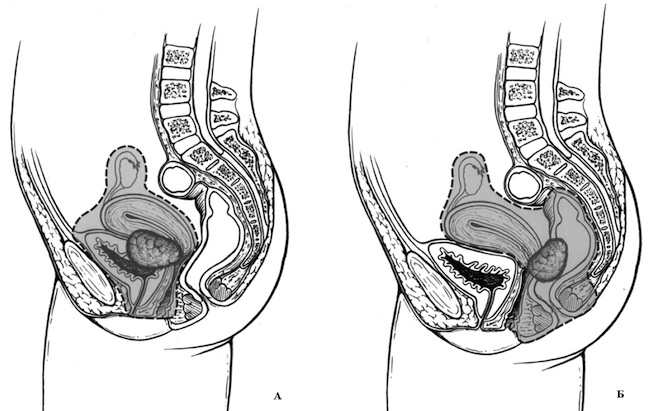
Поражение мочевого пузыря при местно-распространенных опухолях
Известным признаком онкологии шейки матки является влагалищное кровотечение. На последних стадиях заболевания могут появиться боли, резко ухудшится самочувствие.
Признаки заболевания малого таза могут и полностью отсутствовать, когда речь идет о поражении яичников. Тогда больной скорее будет испытывать ноющую боль в брюшине, появится отдышка, кашель, будет испытывать страдания от нарушения в желудочно-кишечном тракте.
Первыми причинами для появления онкологических болезней и их развития в органах малого таза могут быть воспаления кишечного тракта и половых органов, наличие вредных привычек, потребление спиртного и курение табака.
Для оперативной диагностики болезни нужно будет регулярно обращаться к гинекологу, урологу. Помимо этого проводить несложные обследования организма, такие, как ультразвук брюшной полости, анализы крови и мочи.
Симптомы патологии
Течение асцита, вызванного раковыми опухолями, развивается долго, процесс длится неделями и месяцами. При этом наблюдаются первые признаки нарастающего характера, связанные с давлением диафрагмы на верхние органы и нарушением функционирования кишечника:
- тяжесть в животе, метеоризм;
- отрыжка после еды;
- ноющие боли в животе;
- одышка даже в лежачем положении;
- изжога, тошнота, рвота;
- сердечная аритмия.
При кисте и раке яичников у женщин прекращаются менструации. На фоне медленного роста живота многие принимают состояние за беременность, что приводит к поздней диагностике заболевания. После асцита диагностируют онкологию.
У больного также отмечаются отёки стоп, голеней и половых органов в результате метастазирования венозной системы, её закупорки и непоступления крови к сердцу. Все описанные симптомы вторичны. Главные даёт первичная патология – онкология, при этом водянка также требует лечения для предотвращения тяжёлых осложнений.
Профилактика асцита при онкологии
Асцит не является самостоятельной патологией, поэтому основные профилактические меры должны быть направлены на профилактику основного заболевания. Причины развития онкологии до сих пор не изучены, единственной профилактической мерой является нормализация работы органов и обмена веществ. Рекомендуется следить за здоровьем поджелудочной железы, печени, селезёнки и почек, отвечающих за вывод из организма токсинов.
Стандартные методы профилактики:
- ежегодное флюорографическое исследование;
- для женщин регулярные гинекологические осмотры;
- здоровый, активный образ жизни, прогулки на свежем воздухе;
- сбалансированное питание;
- регулярная диспансеризация;
- отказ от вредных привычек.
Методы диагностики и оценки распространённости рака предстательной железы
УЗИ малого таза / ТРУЗИ
Это базовые исследования, благодаря которым врач может оценить объём простаты, состояние семенных пузырьков, рассмотреть лимфоузлы таза и забрюшинного пространства, печени и т.д. Методы ультразвуковой диагностики позволяют с достаточно точно визуализировать саму простату, но не дают возможности судить о злокачественности опухоли и с высокой достоверностью выявлять метастазы размером меньше 5 мм. Как уточняющее исследование рекомендуется МРТ.
Онкомаркеры
ПСА – простат-специфический антиген, повышение концентрации ПСА коррелирует с ДГПЖ и раком простаты (в норме концентрация ПСА в сыворотке крови здорового человека составляет 2,5 – 4 нг/мл);
Тканевый полипептидный специфический антиген (TRS) – при наличии метастазов концентрация TRS повышается в 3 раза;
Антиген стволовых клеток предстательной железы (PSCA) – повышенная концентрация PSCA выявляется при злокачественных опухолях простаты и коррелирует с поздними стадиями заболевания.
Трансректальная биопсия под контролем УЗИ
Биопсия и гистологическая диагностика опухоли – единственный способ подтвердить диагноз РПЖ и определить степень злокачественности новообразования. Чтобы получить достаточное количество ткани для гистологии и оценки по шкале Глисона из простаты под контролем УЗИ отбираются 6 -12 образцов.
МРТУточняющий метод исследования, позволяющий получить серию поперечных и продольных срезов предстательной железы и окружающих тканей. Как правило, оценка местной распространенности опухоли производится врачом именно на основании МРТ. Исследование позволяет с высокой достоверностью определить, вышла ли опухоль за пределы капсулы простаты, затронуты ли органы, расположенные рядом, в каком состоянии находятся лимфоузлы таза (их увеличение может быть признаком начала метастатического процесса).
КТКомпьютерная томография используется для оценки состояния лимфоузлов таза и определения полей облучения при лучевой терапии.
ПЭТ с холином Метод применяется для выявления отдалённых метастазов при высоких уровнях ПСА, а также для оценки состояния лимфоузлов в спорных случаях, когда необходимо отличить воспалительные изменения в лимфоузле от метастазов опухоли.
Тазовая лимфаденэктомияНаиболее точный метод оценки состояния регионарных лимфоузлов при РПЖ, позволяющий выявлять метастазы размером менее 5 мм.
ОстеосцинтиграфияНаиболее информативный метод выявления метастазов в костях. Радиоизотопное сканирование костей может быть рекомендовано всем пациентам с дифференцировкой опухоли по Глисону ≥ 8 или ПСА превышающим 10.
Рентгенография или КТ органов грудной клеткиВыполняется для проверки лёгких на наличие метастазов.
КТ живота и тазаИсследование назначается при подозрении на висцеральные метастазы. В некоторых случаях для выявления отдалённых метастазов может быть рекомендовано МРТ или ПЭТ-КТ всего тела.





































